colSpan=2>
【例
1】分析下列氧化还原反应里电子的转移和化合价的升降,哪种物质是氧化剂,哪种物质是还原剂?(1)Zn+H2SO4===ZnSO4+H2↑ (2)Fe+2HCl===FeCl2+H2↑
分析:
根据氧化还原反应电子转移和化合价升降的关系,以及氧化剂和还原剂的定义答案:

【例
2】分析下列氧化还原反应中化合价的变化关系,注明电子转移方向和总数,并指出氧化剂和还原剂,氧化产物与还原产物。(1)2KMnO4
 K2MnO4+MnO2+O2↑ (2)2Fe2O3+3C
K2MnO4+MnO2+O2↑ (2)2Fe2O3+3C 4Fe+3CO2 (3)3NO2+H2O===2HNO3+NO
4Fe+3CO2 (3)3NO2+H2O===2HNO3+NO(4)HgS+O2
===Hg+SO2 (5)2H2S+SO2===3S+2H2O分析:
本题选择了有代表性的几种氧化还原反应,要求分析化合价变化,表示电子转移方向、总数,并分析氧化还原关系。不论哪种氧化还原反应,解答上述问题的思路及过程均为:标出反应前后发生化合价改变的各元素的化合价;确定电子转移情况,用单线桥或双线桥表示电子转移方向或电子的得与失,在线上注明电子总数;根据电子转移方向或电子的得失分析氧化剂、还原剂、氧化产物与还原产物。答案:

KMnO
4既是氧化剂,又是还原剂;K2MnO4和MnO2是还原产物O2是氧化产物。
Fe
2O3是氧化剂,C是还原剂;Fe是还原产物,CO2是氧化产物。
一部分
NO2是氧化剂,另一部分NO2是还原剂;NO是还原产物,HNO3是氧化产物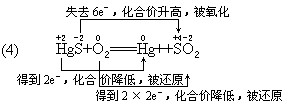
O
2是氧化剂,HgS既是氧化剂,又是还原剂;SO2和Hg是还原产物,SO2是氧化产物。
SO
2是氧化剂,H2S是还原剂;一部分S是还原产物,另一部S是氧化产物。(自《素质教育新学案》)